A cura di Alessandra Russo. Specialista in Tossicologia Medica. Messina
Caso clinico (1)
Un uomo di 65 anni venne ricoverato in ospedale per senso di affaticamento ed iperglicemia.
Il paziente era affetto da diabete mellito di tipo 2 da 6 anni ed era in trattamento con insulina aspart da 10 mesi e con metformina e acarbosio da 6 anni.
L’uomo aveva anche una coronaropatia ed ipertrigliceridemia per cui stava seguendo una terapia con rosuvastatina da 1 mese e che venne sospesa al momento del ricovero in ospedale.
Durante la degenza, il paziente venne trattato con insulina aspart, metformina ed acarbosio.
Gli esami di laboratorio evidenziarono la presenza di ipertrigliceridemia (6,74 mmol/L; range normale 0,56-1,71) (Tabella), per cui venne iniziato un trattamento con fenofibrato (200 mg/die) al fine di ridurre il rischio di pancreatite e di patologie cardiovascolari.
Prima di iniziare il trattamento con fenofibrato, i livelli serici degli enzimi epatici e della bilirubina erano nella norma (Tabella). Non c’era una storia familiare di epatopatia.
Il paziente, in seguito, lamentò l’insorgenza di epigastralgia, dolore precordiale e nausea.
Fu esclusa la presenza di un evento cardiovascolare ischemico e venne sospeso il trattamento con metformina.
Poichè nei giorni successivi il paziente lamentava ancora la stessa sintomatologia e l’insorgenza di senso di affaticamento, venne effettuato un monitoraggio dei livelli degli enzimi epatici, che risultarono elevati (Tabella).
Fu sospeso il trattamento con tutti i farmaci, tra cui il fenofibrato, che rappresentava la causa più probabile a causa della relazione temporale.
Tutti i test effettuati (epatite A, B, C, E, HIV, citomegalovirus, virus Epstein-Barr, anticorpi anti-nucleo, anticorpi anti-muscolo liscio, anticorpi anti-miticondri, i marker tumorali, etc.) risultarono negativi.
I livelli degli enzimi epatici ritornarono nel range della normalità (Tabella e Figura) entro due settimane dall’interruzione del trattamento con fenofibrato.
Tabella. Risultati degli esami di laboratorio durante il periodo di ospedalizzazione
|
Esami di laboratorio |
24/5/2018 |
28/5/2018 |
1/6/2018 |
11/6/2018 |
2/7/2018 |
Range di riferimento |
|
ALT |
20 |
1136,7 |
1060 |
18 |
8,4 |
9-50 U/L |
|
AST |
15,3 |
1213,5 |
826 |
14 |
10,7 |
15-40 U/L |
|
GGT |
39,6 |
335 |
342 |
127 |
35 |
10-60 U/L |
|
ALP |
117,6 |
279,7 |
251 |
119 |
109,3 |
45-125 U/L |
|
LDH |
172,2 |
1052 |
818 |
260 |
158 |
0-250 U/L |
|
Α-HDBH |
147,3 |
454 |
426 |
238 |
123.4 |
90-250 U/L |
|
TP |
73,8 |
69,1 |
75,9 |
83 |
74 |
65-85 g/L |
|
ALB |
43,5 |
40,1 |
39,9 |
41,1 |
43,2 |
40-55 g/L |
|
TBIL |
11,7 |
32,6 |
29,2 |
7,8 |
11,7 |
5,1-19 µmol/L |
|
DBIL |
5,2 |
23,8 |
18,2 |
3,3 |
4,1 |
1,7-6,8 µmol/L |
|
TG |
6,74 |
1,98 |
2,12 |
3,84 |
5,51 |
0,56-1,71 mmol/L |
|
CHO |
5,27 |
4,58 |
5,18 |
5,59 |
5,09 |
3,1-5,7 mmol/L |
|
GLU |
11,6 |
10,9 |
11,3 |
9,2 |
6,3 |
3,8-6,1 mmol/L |
|
Cr |
81,3 |
56,5 |
81,5 |
55,2 |
66,6 |
44-97 µmol/L |
ALB: albumina; ALP: fosfatasi alcalina; ALT: alanina aminotransferasi; AST: aspartato aminotransferasi; CHO: colesterolo totale; Cr: creatinina; DBIL: bilirubina diretta; GGT: gamma‐glutamil transpeptidasi; GLU: glucosio; LDH: lattato deidrogenasi; TBIL: bilirubina totale; TG: trigliceridi; TP: proteine totali; α-HDBH: α-idrossibutirrico deidrogenasi.
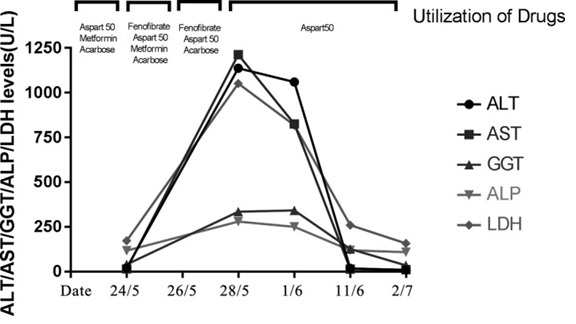
Figura. Utilizzo dei farmaci e andamento dei livelli degli enzimi epatici durante l’ospedalizzazione.
Al momento del ricovero, i livelli degli enzimi epatici erano nel range della norma. Inoltre, il paziente non aveva una storia di epatopatie nè di alcolismo ed era risultato negativo agli esami di laboratorio relativi ad epatiti autoimmuni e virali.
Dopo aver escluso tutti i possibili fattori, fu fatta diagnosi di danno epatico indotto da farmaci.
Il fenofibrato risultò essere il farmaco che con maggiore probabilità poteva aver causato la reazione avversa.
Utilizzando il metodo RUCAM (Roussel Uclaf Causality Assessment Method), il punteggio associato al fenofibrato risultò pari a 10, suggerendo quindi un’associazione altamente probabile tra utilizzo di fenofibrato ed insorgenza di danno epatocellulare.
Gli effetti avversi più frequenti associati all’utilizzo di fenofibrato, riportati in pazienti con danno epatico, includono disturbi gastrointestinali, rash, miopatia, febbre, rabdomiolisi ed insufficienza renale (2-8).
Il danno epatico acuto è raro (0,6%) e di solito è asintomatico, transitorio e di grado lieve. In casi molto severi il danno epatico acuto può determinare la necessità di trapianto epatico e persino avere esito fatale (2,3,5). La latenza varia da 2 settimane a 2 anni (9,10).
Nel caso descritto, il danno epatico acuto di gradi severo è insorto solo 4 giorni dopo l’inizio del trattamento con fenofibrato. I livelli degli enzimi epatici sono rientrati nel range della norma nell’arco di due settimane dall’interruzione del trattamento con questo farmaco.
In base a quanto riportato dagli autori dell’articolo, è importante che, nei pazienti trattati con fenofibrato, venga effettuato il monitoraggio dei livelli degli enzimi epatici ed in particolare dovrebbero essere misurati almeno 2 settimane (o anche prima) dopo l’inizio del trattamento con questo farmaco e poi ogni 3 mesi durante il primo anno di terapia (3).
Bibliografia
- Ma S, et al. Fenofibrate-induced hepatotoxicity: A case with a special feature that is different from those in the LiverTox database. J Clin Pharm Ther 2020; 45: 204-207.
- Dohmen K, et al. Fenofibrate-induced liver injury. World J Gastroenterol 2005; 11: 7702-7703.
- Ho CY, et al. Fenofibrate-induced acute cholestatic hepatitis. J Chin Med Assoc 2004; 67: 245-247.
- Kiskac M, et al. A case of rhabdomyolysis complicated with acute renal failure after resumption of fenofibrate therapy: a first report. Indian J Pharmacol 2013; 45: 305-306.
- Hajdu D, et al. Acute cholestatic hepatitis induced by fenofibrate. J Clin Pharm Ther 2009; 34: 599-602.
- Davis TME, et al. Effects of fenofibrate on renal function in patients with type 2 diabetes mellitus: the fenofibrate intervention and event lowering in diabetes (FIELD) Study. Diabetologia 2011; 54: 280-290.
- Skop V, et al. Hepatotoxic effects of fenofibrate in spontaneously hypertensive rats expressing human C-reactive protein. Physiol Res 2016; 65: 891-899.
- Hedrington MS, Davis SN. Peroxisome proliferator-activated receptor alpha-mediated drug toxicity in the liver. Expert Opin Drug Metab Toxicol 2018; 14: 671-677.
- Ahmad J, et al. Identification and characterization of fenofibrate-induced liver injury. Dig Dis Sci 2017; 62: 3596-3604.
- Rigal J, et al. Severe mixed hepatitis caused by fenofibrate? A review of the literature apropos of a case. Rev Med Interne 1989; 10: 65-67.
Link